通过 MnO2 纳米粒子激活的STING通路重排中性粒细胞增强沙门氏菌介导的肿瘤免疫治疗
摘 要
工程沙门氏菌已成为一种有前途的抗肿瘤微生物免疫疗法;然而,其临床效果却受到限制。在我们的研究中,我们揭示了沙门氏菌治疗效果的一种非剂量依赖性行为,并揭示了中性粒细胞在降低其疗效方面的调节作用。虽然肿瘤内的沙门氏菌定植会招募大量中性粒细胞群,但这些中性粒细胞主要极化为促肿瘤 N2 表型,从而提高 PD-L1 表达并在肿瘤微环境中形成免疫抑制环境。为了绕过这一挑战,我们引入了 MnO 2纳米粒子经过设计以激活 STING 通路。利用 STING 通路刺激 IFN-β 分泌可促使中性粒细胞极化从 N2 表型转变为 N1 表型。这种战略性复极化重塑了肿瘤免疫微环境,使 CD8 + T 细胞的浸润和激活成为可能。通过这些精心策划的机制,沙门氏菌和 MnO 2的联合使用实现了抗肿瘤疗效的协同增强,在20天内实现了肿瘤生长的完全抑制,在40天内实现了80%的存活率,并且没有明显的不良反应迹象。我们的研究不仅揭示了阻碍微生物免疫治疗的关键体内限制因素,还提出了一种增强其疗效的创新策略。这些发现为以利用中性粒细胞的潜力为中心的细胞免疫治疗的发展铺平了道路。
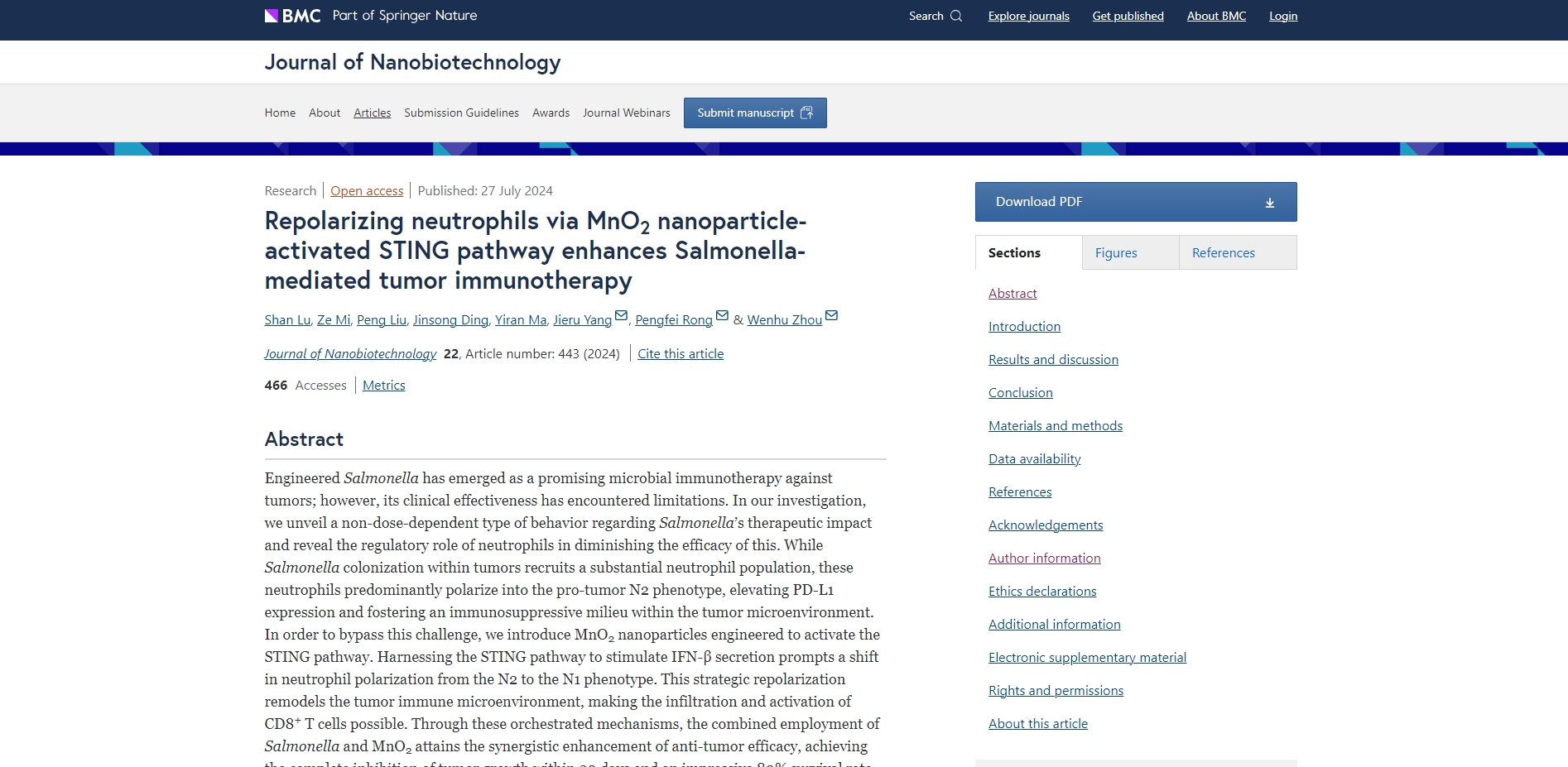
图解摘要
总 结
总之,这项研究阐明了中性粒细胞在细菌介导的肿瘤治疗中至关重要但相对未被探索的作用,并介绍了一种将 Sal 与 MnO 2 NPs 相结合以协同增强疗效的治疗策略。虽然 Sal 在肿瘤内的定植会招募大量中性粒细胞群,但这些中性粒细胞主要极化为 N2 表型,从而有助于建立免疫抑制微环境,从而削弱微生物免疫疗法的有效性。为了克服这一挑战,MnO 2NPs 被设计用于激活 STING 通路,刺激干扰素分泌并协调中性粒细胞向抗肿瘤 N1 表型复极化。这种战略性重编程预示着肿瘤免疫微环境的范式转变。实验结果强调了这种联合治疗策略在有效阻止肿瘤生长、提高小鼠存活率和展示良好生物安全性方面的效力。我们的研究结果使人们对肿瘤治疗中的中性粒细胞动力学有了更细致的理解,为加强微生物免疫疗法的有效性提供了一条有希望的途径。这项全面的研究不仅为微生物免疫疗法中遇到的挑战提供了解决方案,而且为基于细胞的免疫疗法的未来发展奠定了坚实的基础,专注于利用中性粒细胞的潜力制定精细的癌症治疗策略。

